Белковые модули (домены)
Обычно белки, образованные одной полипептидной цепью, представляют собой компактное образование, каждая часть которого не может функционировать и существовать отдельно, сохраняя прежнюю структуру. Однако, в некоторых случаях, при большом содержании аминокислотных остатков (более 200), в трехмерной структуре обнаруживается не одна, а несколько независимых компактных областей одной полипептидной цепи. Эти фрагменты полипептидной цепи, сходные по свойствам с самостоятельными глобулярными белками, называются модулями или доменами . Например, в дегидрогеназах два домена, один связывает НАД + и этот домен сходен по строению у всех НАД-зависимых дегидрогеназ, а другой домен связывает субстрат и отличается по структуре у разных дегидрогеназ.
Синтаза жирных кислот, представляющая одну полипептидную цепь, имеет 7 доменов, для катализа 7 реакций. Предполагается, что домены синтазы некогда объединились в один белок в результате слияния генов. Соединение модулей (доменов) в один белок способствует быстрому появлению и эволюции новых функциональных белков.
Активный центр белка – это центр связывания белка с лигандом. На поверхности глобулы образуется участок, который может присоединять к себе другие молекулы называемые лигандами . Активный центр белка формируется из боковых групп аминокислот, сближенных на уровне третичной структуры. В линейной последовательности пептидной цепи они могут находиться на расстоянии значительно удаленном друг от друга. Белки проявляют высокую специфичность при взаимодействии с лигандом. Высокая специфичность взаимодействия белка с лигандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда. Комплементарность – это пространственное и химическое соответствие взаимодействующих молекул. Центры связывания белка с лигандом часто располагаются между доменами (например, центр связывания трипсина с его лигандом имеет 2 домена разделенных бороздкой).
В основе функционирования белков лежит их специфическое взаимодействие с лигандами. 50000 индивидуальных белков, содержащих уникальные активные центры, способные связываться только со специфическими лигандами и, благодаря особенностям строения активного центра, проявлять свойственные им функции. Очевидно, в первичной структуре содержится информация о функции белков.
Четвертичная структура - это высший уровень структурной организации, возможный не у всех белков. Под четвертичной структурой понимают способ укладки в пространстве полипептидных цепей и формирование единого в структурном и функциональном отношениях макромолекулярного образования. Каждая отдельно взятая полипептидная цепь, получившая название протомера или субъединицы , чаще всего не обладает биологической активностью. Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров. Образовавшуюся молекулу принято называть олигомером (мультимером) .
Четвертичную структуру стабилизируют нековалентные связи, которые возникают между контактными площадками протомеров, которые взаимодействуют друг с другом по типу комплементарности.
К белкам, имеющим четвертичную структуру, относятся многие ферменты (лактатдегидрогеназа, глутаматдегидрогеназа и др.), а также гемоглобин, сократительный белок мышц миозин. Одни белки имеют небольшое число субъединиц 2 – 8, другие сотни и даже тысячи субъединиц. Например, белок вируса табачной мозайки имеет 2130 субъединиц.
Типичным примером белка, имеющего четвертичную структуру, является гемоглобин. Молекула гемоглобина состоит из 4 субъединиц, т. е. полипептидных цепей, каждая из которых связана с гемом, из них 2 полипептидные цепи называются -2афьла и -2бета Они различаются первичной структурой и длиной полипептидной цепи.
Связи, образующие четвертичную структуру менее прочные. Под влиянием некоторых агентов происходит разделение белка на отдельные субъединицы. При удалении агента субъединицы могут вновь объединиться и биологическая функция белка восстанавливается. Так при добавлении к раствору гемоглобина мочевины он распадается на 4 составляющие его субъединицы, при удалении мочевины структурная и функциональная роль гемоглобина восстанавливается.
), а также в химии комплексных соединений , обозначая там присоединенные к одному или нескольким центральным (комплексообразующим) атомам металла частицы.
В неорганической химии
Чаще всего такое связывание происходит с образованием так называемой «координационной» донорно-акцепторной связи , где лиганды выступают в роли основания Льюиса , то есть являются донорами электронной пары . При присоединении лигандов к центральному атому химические свойства комплексообразователя и самих лигандов часто претерпевают значительные изменения.
Номенклатура лигандов
- первым в названии соединения в именительном падеже называется анион, а затем в родительном - катион
- в названии комплексного иона сначала перечисляются лиганды в алфавитном порядке, а затем центральный атом
- центральный атом в нейтральных катионных комплексах называются русским названием, а в анионах корнем латинского названия с суффиксом «ат». После названия центрального атома указывается степень окисления.
- число лигандов, присоединенных к центральному атому, указывается приставками «моно», «ди», «три», «тетра», «пента», и т. д.
Характеристики лигандов
Электронное строение
Собственно, важнейшая характеристика лиганда, позволяющая оценить и спрогнозировать его способности к комплексообразованию и саморазрушению D-орбитали - разрушения соединения в целом. В первом приближении включает в себя количество электронных пар, которые лиганд способен выделить на создание координационных связей и электроотрицательность донирующего атома или функциональной группы .
Дентатность
Число занимаемых лигандом координационных мест центрального атома (или атомов), называется дентатностью (от лат. dens, dent- - зуб ). Лиганды, занимающие одно координационное место, называются моно дентатными (например, N H 3), два - би дентатными (оксалат-анион [O -C(=O)-C(=O)-O ] 2−). Лиганды, способные занять большее количество мест, обычно обозначают как поли дентатные. Например, этилендиаминтетрауксусная кислота (EDTA), способная занять шесть координационных мест.
Кроме дентатности, существует характеристика, отражающая количество атомов лиганда, связанных с одним координационным местом центрального атома. В английской литературе обозначается словом hapticity и имеет номенклатурное обозначение с соответствующим надстрочным индексом. Хотя устоявшегося термина в русском языке она, по-видимому, не имеет, в некоторых источниках можно встретить кальку «гаптность» . Как пример, можно привести циклопентадиенильный лиганд в металлоцентровых комплексах, занимающий одно координационное место (то есть, являющийся монодентатным) и связанный через все пять атомов углерода: η 5 - − .
Способы координации
 Лиганды с дентатностью больше двух способны образовывать хелатные комплексы
(греч. χηλή
- клешня) - комплексы, где центральный атом включен в один или более циклов с молекулой лиганда. Такие лиганды называются хелатирующими
. Как пример можно привести комплексы тетрааниона той же EDTA, обратив внимание, что несколько из четырёх связей M-O в нём могут формально являться ионными
.
Лиганды с дентатностью больше двух способны образовывать хелатные комплексы
(греч. χηλή
- клешня) - комплексы, где центральный атом включен в один или более циклов с молекулой лиганда. Такие лиганды называются хелатирующими
. Как пример можно привести комплексы тетрааниона той же EDTA, обратив внимание, что несколько из четырёх связей M-O в нём могут формально являться ионными
.
При образовани хелатных комплексов часто наблюдается хелатный эффект - большая их стабильность по сравнению с аналогичными комплексами не-хелатирующих лигандов. Он достигается за счет большего экранирования центрального атома от замещающих воздействий и энтропийного эффекта. Например, константа диссоциации аммиачного комплекса кадмия 2+ почти в 1500 раз меньше, чем комплекса с этилендиамином 2+ . Причина этого заключается в том, что при взаимодействии гидратированного иона кадмия(II) с этилендиамином две молекулы лиганда вытесняют четыре молекулы воды. При этом число свободных частиц в системе значительно возрастает, и энтропия системы возрастает (а внутренняя упорядоченность комплекса соответственно растёт). То есть причина хелатного эффекта - увеличение энтропии системы при замещении монодентатных лигандов полидентатнымии и, как следствие, снижение энергии Гиббса .
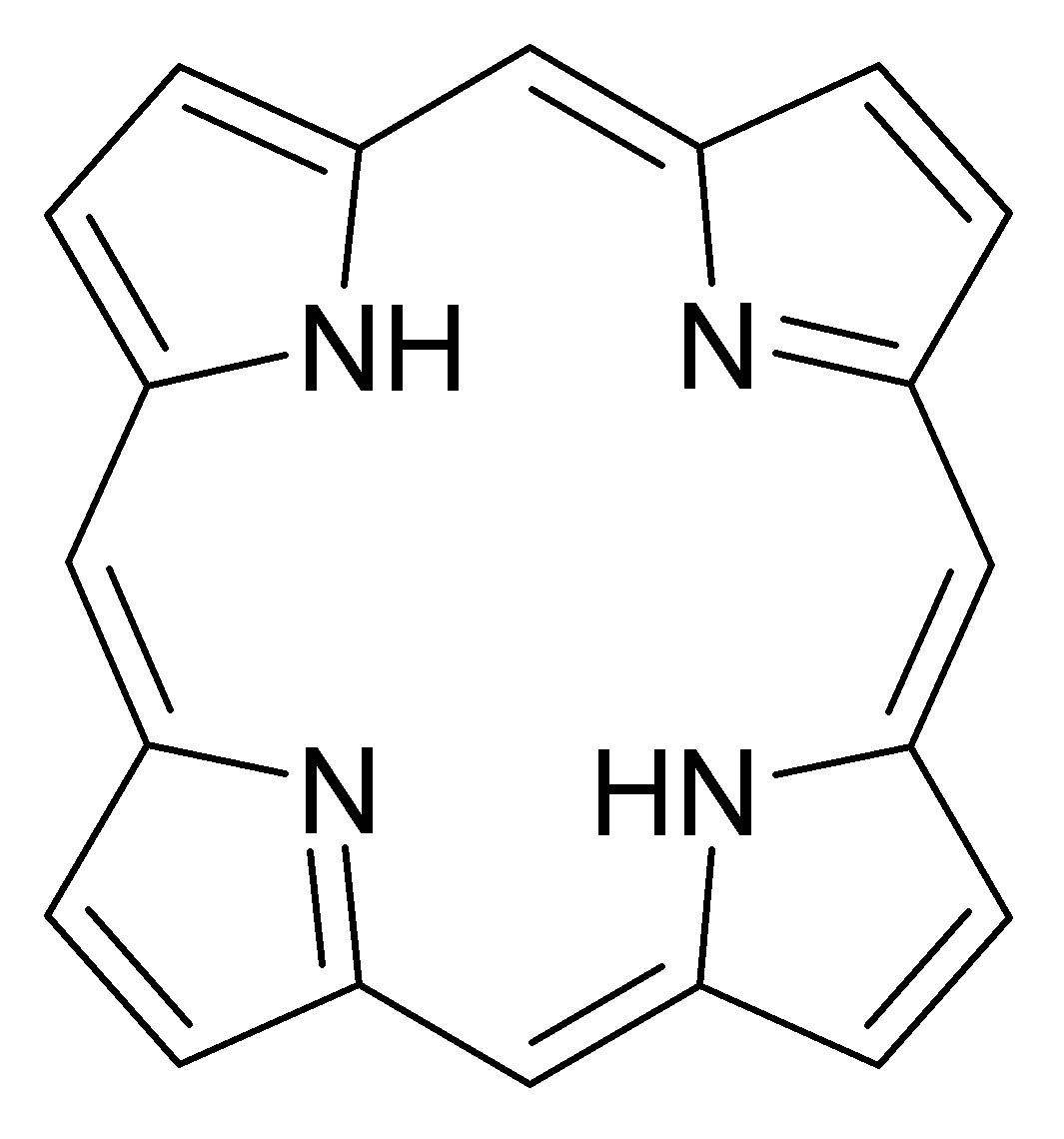 Среди хелатирующих лигандов можно выделить класс макроциклических лигандов - молекул с достаточным для помещения атома комплексообразователя размером внутрициклического пространства. Примером таких соединений могут служить порфириновые основания - основы важнейших биохимических комплексов, таких, как гемоглобин , хлорофилл и бактериохлорофилл . Также в качестве макроциклических лигандов могут выступать краун-эфиры , каликсарены и др.
Среди хелатирующих лигандов можно выделить класс макроциклических лигандов - молекул с достаточным для помещения атома комплексообразователя размером внутрициклического пространства. Примером таких соединений могут служить порфириновые основания - основы важнейших биохимических комплексов, таких, как гемоглобин , хлорофилл и бактериохлорофилл . Также в качестве макроциклических лигандов могут выступать краун-эфиры , каликсарены и др.
Лиганды также могут являться мостиковыми, образуя связи между различными центральными атомами в би- или полиядерных комплексах. Мостиковые лиганды обозначаются греческой буквой μ (мю ).
Напишите отзыв о статье "Лиганд"
Примечания
|
||||||||||||||||||
Отрывок, характеризующий Лиганд
– Ежели бы все воевали только по своим убеждениям, войны бы не было, – сказал он.– Это то и было бы прекрасно, – сказал Пьер.
Князь Андрей усмехнулся.
– Очень может быть, что это было бы прекрасно, но этого никогда не будет…
– Ну, для чего вы идете на войну? – спросил Пьер.
– Для чего? я не знаю. Так надо. Кроме того я иду… – Oн остановился. – Я иду потому, что эта жизнь, которую я веду здесь, эта жизнь – не по мне!
В соседней комнате зашумело женское платье. Как будто очнувшись, князь Андрей встряхнулся, и лицо его приняло то же выражение, какое оно имело в гостиной Анны Павловны. Пьер спустил ноги с дивана. Вошла княгиня. Она была уже в другом, домашнем, но столь же элегантном и свежем платье. Князь Андрей встал, учтиво подвигая ей кресло.
– Отчего, я часто думаю, – заговорила она, как всегда, по французски, поспешно и хлопотливо усаживаясь в кресло, – отчего Анет не вышла замуж? Как вы все глупы, messurs, что на ней не женились. Вы меня извините, но вы ничего не понимаете в женщинах толку. Какой вы спорщик, мсье Пьер.
– Я и с мужем вашим всё спорю; не понимаю, зачем он хочет итти на войну, – сказал Пьер, без всякого стеснения (столь обыкновенного в отношениях молодого мужчины к молодой женщине) обращаясь к княгине.
Княгиня встрепенулась. Видимо, слова Пьера затронули ее за живое.
– Ах, вот я то же говорю! – сказала она. – Я не понимаю, решительно не понимаю, отчего мужчины не могут жить без войны? Отчего мы, женщины, ничего не хотим, ничего нам не нужно? Ну, вот вы будьте судьею. Я ему всё говорю: здесь он адъютант у дяди, самое блестящее положение. Все его так знают, так ценят. На днях у Апраксиных я слышала, как одна дама спрашивает: «c"est ca le fameux prince Andre?» Ma parole d"honneur! [Это знаменитый князь Андрей? Честное слово!] – Она засмеялась. – Он так везде принят. Он очень легко может быть и флигель адъютантом. Вы знаете, государь очень милостиво говорил с ним. Мы с Анет говорили, это очень легко было бы устроить. Как вы думаете?
Пьер посмотрел на князя Андрея и, заметив, что разговор этот не нравился его другу, ничего не отвечал.
– Когда вы едете? – спросил он.
– Ah! ne me parlez pas de ce depart, ne m"en parlez pas. Je ne veux pas en entendre parler, [Ах, не говорите мне про этот отъезд! Я не хочу про него слышать,] – заговорила княгиня таким капризно игривым тоном, каким она говорила с Ипполитом в гостиной, и который так, очевидно, не шел к семейному кружку, где Пьер был как бы членом. – Сегодня, когда я подумала, что надо прервать все эти дорогие отношения… И потом, ты знаешь, Andre? – Она значительно мигнула мужу. – J"ai peur, j"ai peur! [Мне страшно, мне страшно!] – прошептала она, содрогаясь спиною.
Муж посмотрел на нее с таким видом, как будто он был удивлен, заметив, что кто то еще, кроме его и Пьера, находился в комнате; и он с холодною учтивостью вопросительно обратился к жене:
– Чего ты боишься, Лиза? Я не могу понять, – сказал он.
– Вот как все мужчины эгоисты; все, все эгоисты! Сам из за своих прихотей, Бог знает зачем, бросает меня, запирает в деревню одну.
– С отцом и сестрой, не забудь, – тихо сказал князь Андрей.
– Всё равно одна, без моих друзей… И хочет, чтобы я не боялась.
Тон ее уже был ворчливый, губка поднялась, придавая лицу не радостное, а зверское, беличье выраженье. Она замолчала, как будто находя неприличным говорить при Пьере про свою беременность, тогда как в этом и состояла сущность дела.
– Всё таки я не понял, de quoi vous avez peur, [Чего ты боишься,] – медлительно проговорил князь Андрей, не спуская глаз с жены.
Княгиня покраснела и отчаянно взмахнула руками.
– Non, Andre, je dis que vous avez tellement, tellement change… [Нет, Андрей, я говорю: ты так, так переменился…]
– Твой доктор велит тебе раньше ложиться, – сказал князь Андрей. – Ты бы шла спать.
Княгиня ничего не сказала, и вдруг короткая с усиками губка задрожала; князь Андрей, встав и пожав плечами, прошел по комнате.
Пьер удивленно и наивно смотрел через очки то на него, то на княгиню и зашевелился, как будто он тоже хотел встать, но опять раздумывал.
– Что мне за дело, что тут мсье Пьер, – вдруг сказала маленькая княгиня, и хорошенькое лицо ее вдруг распустилось в слезливую гримасу. – Я тебе давно хотела сказать, Andre: за что ты ко мне так переменился? Что я тебе сделала? Ты едешь в армию, ты меня не жалеешь. За что?
– Lise! – только сказал князь Андрей; но в этом слове были и просьба, и угроза, и, главное, уверение в том, что она сама раскается в своих словах; но она торопливо продолжала:
– Ты обращаешься со мной, как с больною или с ребенком. Я всё вижу. Разве ты такой был полгода назад?
– Lise, я прошу вас перестать, – сказал князь Андрей еще выразительнее.
Пьер, всё более и более приходивший в волнение во время этого разговора, встал и подошел к княгине. Он, казалось, не мог переносить вида слез и сам готов был заплакать.
– Успокойтесь, княгиня. Вам это так кажется, потому что я вас уверяю, я сам испытал… отчего… потому что… Нет, извините, чужой тут лишний… Нет, успокойтесь… Прощайте…
Князь Андрей остановил его за руку.
– Нет, постой, Пьер. Княгиня так добра, что не захочет лишить меня удовольствия провести с тобою вечер.
– Нет, он только о себе думает, – проговорила княгиня, не удерживая сердитых слез.
– Lise, – сказал сухо князь Андрей, поднимая тон на ту степень, которая показывает, что терпение истощено.
Вдруг сердитое беличье выражение красивого личика княгини заменилось привлекательным и возбуждающим сострадание выражением страха; она исподлобья взглянула своими прекрасными глазками на мужа, и на лице ее показалось то робкое и признающееся выражение, какое бывает у собаки, быстро, но слабо помахивающей опущенным хвостом.
В неорганической химии
Чаще всего такое связывание происходит с образованием так называемой «координационной» донорно-акцепторной связи , где лиганды выступают в роли основания Льюиса , то есть являются донорами электронной пары. При присоединении лигандов к центральному атому химические свойства комплексообразователя и самих лигандов часто претерпевают значительные изменения.
Номенклатура лигандов
- первым в названии соединения в именительном падеже называется анион, а затем в родительном - катион
- в названии комплексного иона сначала перечисляются лиганды в алфавитном порядке, а затем центральный атом
- центральный атом в нейтральных катионных комплексах называются русским названием, а в анионах корнем латинского названия с суффиксом «ат». После названия центрального атома указывается степень окисления.
- число лигандов, присоединенных к центральному атому, указывается приставками «моно», «ди», «три», «тетра», «пента», и т. д.
Характеристики лигандов
Электронное строение
Собственно, важнейшая характеристика лиганда, позволяющая оценить и спрогнозировать его способности к комплексообразованию и саморазрушению D-орбитали - разрушения соединения в целом. В первом приближении включает в себя количество электронных пар, которые лиганд способен выделить на создание координационных связей и электроотрицательность донирующего атома или функциональной группы .
Дентатность
Число занимаемых лигандом координационных мест центрального атома (или атомов), называется дентатностью (от лат. dens, dent- - зуб ). Лиганды, занимающие одно координационное место, называются моно дентатными (например, N H 3), два - би дентатными (оксалат-анион [O -C(=O)-C(=O)-O ] 2−). Лиганды, способные занять большее количество мест, обычно обозначают как поли дентатные. Например, этилендиаминтетрауксусная кислота (EDTA), способная занять шесть координационных мест.
Кроме дентатности, существует характеристика, отражающая количество атомов лиганда, связанных с одним координационным местом центрального атома. В английской литературе обозначается словом hapticity и имеет номенклатурное обозначение с соответствующим надстрочным индексом. Хотя устоявшегося термина в русском языке она, по-видимому, не имеет, в некоторых источниках можно встретить кальку «гаптность» . Как пример, можно привести циклопентадиенильный лиганд в металлоцентровых комплексах, занимающий одно координационное место (то есть, являющийся монодентатным) и связанный через все пять атомов углерода: η 5 - − .
Способы координации

Хелатный комплекс EDTA 4−
Лиганды с дентатностью больше двух способны образовывать хелатные комплексы (греч. χηλή - коготь) - комплексы, где центральный атом включен в один или более циклов с молекулой лиганда. Такие лиганды называются хелатирующими . Как пример можно привести комплексы тетрааниона той же EDTA, обратив внимание, что несколько из четырёх связей M-O в нём могут формально являться ионными .
При образовани хелатных комплексов часто наблюдается хелатный эффект - большая их стабильность по сравнению с аналогичными комплексами не-хелатирующих лигандов. Он достигается за счет большего экранирования центрального атома от замещающих воздействий и энтропийного эффекта. Например, константа диссоциации аммиачного комплекса кадмия 2+ почти в 1500 раз меньше, чем комплекса с этилендиамином 2+ . Причина этого заключается в том, что при взаимодействии гидратированного иона кадмия(II) с этилендиамином две молекулы лиганда вытесняют четыре молекулы воды. При этом число свободных частиц в системе значительно возрастает, и энтропия системы возрастает (а внутренняя упорядоченность комплекса соответствено растёт). То есть причина хелатного эффекта - увеличение энтропии системы при замещении монодентатных лигандов полидентатнымии и, как следствие, снижение энергии Гиббса .

Порфириновый цикл
Лиганды также могут являться мостиковыми, образуя связи между различными центральными атомами в би- или полиядерных комплексах. Мостиковые лиганды обозначаются греческой буквой μ (мю ).
Примечания
| Структурная химия | |
|---|---|
| Химическая связь : | Ароматичность | Ковалентная связь | Ионная связь | Металлическая связь | Водородная связь | Донорно-акцепторная связь | Таутомерия | Ван-дер-Ваальсова связь |
| Отображение структуры: | |
Биологическая химия Лелевич Владимир Валерьянович
Функционирование белков
Функционирование белков
Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от всех остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных функций.
Необходимое условие для функцинирования белков – присоединение к нему другого вещества, которое называют лигандом. Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандом высокоспецифично, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром.
Активный центр белков и избирательность связывания его с лигандом
Активный центр белков – определённый участок белковой молекулы, как правило, находящийся в её углублении, сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.
Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка и структуры лиганда.
Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка, активный центр способен к небольшим изменениям и «подгоняется» под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
Характеристика активного центра
Активный центр белка – относительно изолированный от окружающей белок среды участок, сформированный аминокислотными остатками. В этом участке каждый остаток, благодаря своему индивидуальному размеру и функциональным группам, формирует «рельеф» активного центра.
Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности.
Часто активный центр формируется таким образом, что доступ воды к функциональным группам его радикалов ограничен, т.е. создаются условия для связывания лиганда с радикалами аминокислот.
Центр связывания белка с лигандом часто располагается между доменами. Например, протеолитический фермент трипсин, участвующий в гидролизе пептидных связей пищевых белков в кишечнике, имеет 2 домена, разделённых бороздкой. Внутренняя поверхность бороздки формируется аминокислотными радикалами этих доменов, стоящими в полипептидной цепи далеко друг от друга (Сер177, Гис40, Асп85).
Разные домены в белке могут перемещаться друг относительно друга при взаимодействии с лигандом, что облегчает дальнейшее функционирование белка. Основное свойство белков, лежащее в основе их функций – избирательность присоединения специфических лигандов к определённым участкам белковой молекулы.
Многообразие лигандов:
1. Лигандами могут быть неорганические (часто ионы металлов) и органические вещества, низкомолекулярные и высокомолекулярные вещества;
2. существуют лиганды, которые изменяют свою химическую структуру при присоединении к активному центру белка (изменения субстрата в активном центре фермента);
3. существуют лиганды, присоединяющиеся к белку только в момент функционирования (например, О 2 , транспортируемый гемоглобином), и лиганды, постоянно связанные с белком, выполняющие вспомогательную роль при функционировании белков (например, железо, входящее в состав гемоглобина).
Из книги Размножение собак автора Коваленко Елена ЕвгеньевнаФункционирование половой системы Деятельность половой системы регулируется гормонами - веществами белковой природы с высокой биологической активностью и избирательностью действия. Именно эти свойства гормонов обеспечивают гуморальную связь между органами,
Из книги Возрастная анатомия и физиология автора Антонова Ольга Александровна4.5. Строение и функционирование спинного мозга Спинной мозг представляет собой длинный тяж длиной (у взрослого человека) около 45 см. Вверху он переходит в продолговатый мозг, внизу (в районе I–II поясничных позвонков) спинной мозг суживается и имеет форму конуса,
Из книги Биология [Полный справочник для подготовки к ЕГЭ] автора Лернер Георгий Исаакович4.6. Строение и функционирование головного мозга
Из книги Недостающее звено автора Иди Мейтленд Из книги Беседы о жизни автора Галактионов Станислав ГеннадиевичГенеалогическое древо (свидетельство белков) Генеалогическое древо (свидетельство белков)Различия в белках двух видов отражают эволюционные изменения этих видов после их отделения от общего предка. Анализ показывает, что между альбуминами кровяных сывороток шимпанзе
Из книги Эволюция [Классические идеи в свете новых открытий] автораГлава 2. Молекулярная архитектура белков Не будем скрывать: покончив с первой главой, авторы (а возможно, и читатель) испытали некоторое облегчение. В конце концов цель ее заключалась лишь в том, чтобы дать читателю сведения, необходимые для понимания последующих глав,
Из книги Эволюция человека. Книга 1. Обезьяны, кости и гены автора Марков Александр ВладимировичВселенная древних белков продолжает расширяться В 2010 году журнал Nature опубликовал интересную статью об эволюционном движении белков по ландшафтам приспособленности (Povolotskaya, Kondrashov, 2010). Авторы работы решили сравнить аминокислотные последовательности 572 древних белков,
Из книги Биологическая химия автора Лелевич Владимир ВалерьяновичИзменения белков Те участки генома, которые кодируют белки, изменились на удивление мало. Различия в аминокислотных последовательностях белков у человека и шимпанзе составляют значительно менее 1 %, да и из этих немногочисленных различий большая часть либо не имеет
Из книги автораГлава 2. Строение и функции белков Белки – высокомолекулярные азотсодержащие органические соединения, состоящие из аминокислот, соединенных в полипептидные цепи с помощью пептидных связей, и имеющие сложную структурную организацию.История изучения белковВ 1728 г.
Из книги автораУровни структурной организации белков Первичная структура – строго определенная линейная последовательность аминокислот в полипептидной цепочке.Стратегические принципы изучения первичной структуры белка претерпевали значительные изменения по мере развития и
Из книги автораПосттрансляционные изменения белков Многие белки синтезируются в неактивном виде (предшественники) и после схождения с рибосом подвергаются постсинтетическим структурным модификациям. Эти конформационные и структурные изменения полипептидных цепей получили
Из книги автораГлава 23. Обмен аминокислот. Динамическое состояние белков организма Значение аминокислот для организма в первую очередь заключается в том, что они используются для синтеза белков, метаболизм которых занимает особое место в процессах обмена веществ между организмом и
Из книги автораПереваривание белков в желудочно-кишечном тракте Переваривание белков начинается в желудке под действием ферментов желудочного сока. За сутки его выделяется до 2,5 литров и он отличается от других пищеварительных соков сильно кислой реакцией, благодаря присутствию
Из книги автораРасщепление белков в тканях Осуществляется с помощью протеолитических лизосомальных ферментов катепсинов. По строению активного центра выделяют цистеиновые, сериновые, карбоксильные и металлопротеиновые катепсины. Роль катепсинов:1. создание биологически активных
Из книги автораРоль печени в обмене аминокислот и белков Печень играет центральную роль в обмене белков и других азотсодержащих соединений. Она выполняет следующие функции:1. синтез специфических белков плазмы: - в печени синтезируется: 100 % альбуминов, 75 – 90 % ?-глобулинов, 50 %
Из книги автораХарактеристика белков сыворотки крови Белки системы комплемента – к этой системе относятся 20 белков, циркулирующих в крови в форме неактивных предшественников. Их активация происходит под действием специфических веществ, обладающих протеолитической активностью.
Тема: ТРАНСМЕМБРАННЫЙ ПЕРЕНОС
Внутриклеточные рецепторы: https://www.youtube.com/watch?v=Nm9u4lNCPyM
Метаботропные мембранные рецепторы, связанные с системой вторичных посредников: https://www.youtube.com/watch?v=dQ4yVuLAbH0
Метаботропные мембранные рецепторы, связанные с тирозинкиназной активностью:
Виды трансмембранного переноса.
Типы каналов трансмембранного переноса.
Понятие о полярных и неполярных веществах.
Трансмембранная избирательная проницаемость поддерживает клеточный гомеостаз, оптимальное содержание в клетке ионов, воды, ферментов и субстратов. Пути реализации избирательной проницаемости мембран: пассивный транспорт, катализируемый транспорт (о6легченная диффузия), активный транспорт. Гидрофобный характер сердцевины бислоя определяет возможность (или невозможность) непосредственного проникновения через мембрану различных с физико-химической точки зрения веществ (в первую очередь, полярных и неполярных).
Неполярные вещества (например, холестерин и его производные) свободно проникают через биологические мембраны. По этой причине эндоцитоз и экзоцитоз полярных соединений (например, пептидных гормонов) происходят при помощи мембранных пузырьков, а секреция стероидных гормонов - без участия таких пузырьков. По этой же причине рецепторы неполярных молекул (например, стероидных гормонов) расположены внутри клетки.
Полярные вещества (например, белки и ионы) не могут проникать через биологические мембраны. Именно поэтому рецепторы полярных молекул (например, пептидных гормонов) встроены в плазматическую мембрану, а передачу сигнала к другим клеточным компартментам осуществляют вторые посредники. По этой же причине трансмембранный перенос полярных соединений осуществляют специальные системы, встроенные в биологические мембраны.
Избирательную проницаемость обеспечивает клеточная мембрана; рецепторнуюфункцию реализуют гликопротеиды, углеводные части которых расположены в гликокаликсе;сохранение формы и подвижность обеспечивают фибриллярные и тубулярные белки в подмембранномслое и т.д.
Понятие о рецепторе и лиганде
Клеточный рецептор - молекула на поверхности клетки, ядра, клеточных органелл или растворенная в цитоплазме. Клеточный рецептор специфично реагирует изменением своей пространственной конфигурации (формы) на присоединение к ней молекулы определенного химического вещества – лигáнда , передающего внешний регуляторный сигнал. Это в свою очередь, передает этот сигнал внутрь клетки или клеточной органеллы. Место на рецепторе, куда присоединяется лигáнд, называется сайт. У одного и того же рецептора может быть несколько сайтов. Клеточные рецепторы можно разделить на два основных класса - мембранные рецепторы (расположены на мембране отделяющей клетку от внешней среды) и внутриклеточные рецепторы.
Вещество, специфически соединяющееся с рецептором, называется лигандом (мессенджером) этого рецептора. Т.о., лиганд (синоним: мессенджер) – это химическое вещество, способное взаимодействовать с рецептором. Результат этого взаимодействия может быть различным. Если лиганд (мессенджер) приводит к изменению формы рецептора и его активации его называет агонистом . Если лиганд (мессенджер) изменяют форму (конформацию) рецептора и блокируют этот рецептор его называют антагонистом.
Когда речь идет об органах чувств, лигандами (мессенджерами) являются вещества, воздействующие на рецепторы обоняния или вкуса.
Существуют также термочувствительные белки-рецепторы и белки-рецепторы, реагирующие на изменение мембранного потенциала.
Рецепторы для водорастворимых лигандов (мессенджеров) - белковые гормоны, адреналин, норадреналин - расположены на поверхности мембраны (мембранные рецепторы), это обусловлено тем, что гидрофильные лиганды не могут пройти через гидрофобную поверхность мембраны. Жирорастворимые лиганды (мессенджеры) легко проходят через фосфолипидный бислой мембраны клетки и ядра, а потому рецепторы (внутриклеточные рецепторы) клетка к ним располагает внутри: на органеллах, ядре. Примеры жирорастворимых лигандов могут быть стероидные гормоны надпочечников, половых желез.
Ко всему прочему лиганды можно разделить на экзогенные (поступающие извне) и эндогенные (образуются внутри организма). Как правило, если какое-то экзогенное вещество имеет рецепторы на клетках, то в организме есть и эндогенные лиганды для данного рецептора. Так, например, эндогенными лигандом каннабиноидных рецепторов, с которыми связываются алкалоиды конопли, является вещество анандамид, производимое организмом из арахидоновой жирной кислоты. Или эндорфиновые рецепторы (играют важную роль в формировании боли и эмоционального состояния): могут соединяться с эндогенными лигандами - эндорфины, а могут связываться с наркотиками группы морфина.





